|
DOC : Formation Individualisée |
DOC : Elève. |
|
DOSSIER N° Matière : |
Information
« TRAVAUX » |
|
OBJECTIFS : |
I ) Pré
requis:
|
i9 |
:i |
|
|
i9 |
|
:i |
II )
ENVIRONNEMENT du dossier :
|
Dossier précédent : |
Dossier suivant : |
Info : |
III )
LECON n° : ATOMES- CLASSIFICATION PERIODIQUE -
IONS
Chapitres
:
|
i9 |
Représentation
d'un atome. |
:i |
|
i9 |
ION |
:i |
|
i9 |
Notation
des ions |
:i |
|
i9 |
Molécules
|
:i |
IV) INFORMATIONS
« formation leçon » :
|
Travaux auto
- formation. |
|
Corrigé des travaux
auto - formation. |
||||
|
Corrigé |
||||||
V ) DEVOIRS
( écrits):
|
Devoir diagnostique L tests. |
Ÿ |
|
Devoir Auto
- formatif
(intégré au cours) |
Ÿ |
|
Devoir Formatif « Contrôle :
savoir » ; (remédiation) |
Ÿ |
|
Ÿ |
|
|
Devoir sommatif. |
Ÿ |
|
Devoir certificatif : (remédiation) |
Ÿ |
* remédiation : ces documents peuvent être
réutilisés ( tout ou partie) pour conclure une formation .
|
Leçon |
Titre |
|
N° |
CHAPITRES
|
i9 |
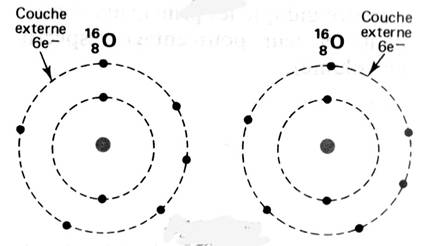
Représentation d'un atome. |
:i |
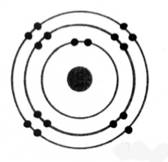
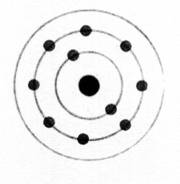
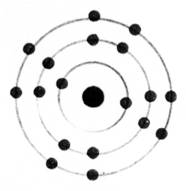
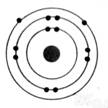
Les atomes
se représentent de façon élémentaire par
le modèle de
BOHR.
Les
électrons sont répartis autour du noyau de
l'atome sur des cercles concentriques appelés "couches
électroniques"
Ces
couches électroniques correspondent à des niveaux d'énergie.
Elles sont
notées K ; L ; M ; N ….. et peuvent
comporter respectivement 2 ; 8 ; 18 ; 32 ,….. Électrons au maximum. ( les
couches M , N … possèdent des sous couches de 8 électrons)
La
dernière couche occupée est appelée "couche externe" et quelque soit
le nombre maximum d'électrons qu'elle peut contenir, elle n'en possède jamais
plus de 8.
Les
propriétés chimiques des atomes d'un élément sont déterminées par leur
structure électronique externe. (C'est à
dire par le nombre d'électrons de la
couche externe)
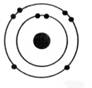
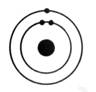
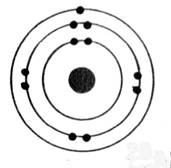
Exemple:
de représentation:
|
ReprésentationLvoir
modèle) |
Structure
électronique: |
|
|
Oxygène |
|
K² ; L6 On
dénombre : 8 électrons |
|
Aluminium
|
|
K² ; L8, M3 On
dénombre : 13 électrons |
|
Lithium |
|
K², L1 On
dénombre : 3 électrons |
|
i9 |
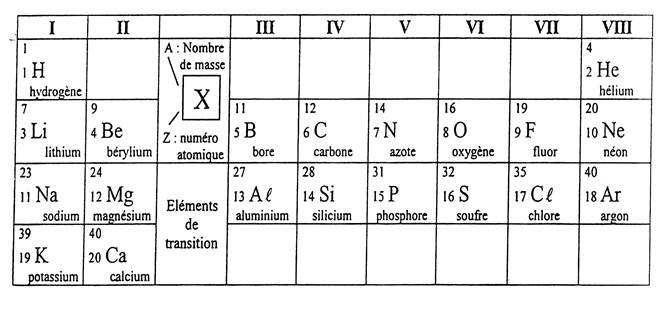
La
classification périodique (voir doc.
.tableau) |
:i |
La
connaissance de la structure électronique des atomes des différents éléments
permet de comprendre le principe de classification,connue sous le nom de
classification périodique des éléments et proposée par le chimiste russe
Mendeleïev.
· Les éléments sont classés par numéro atomique
"Z" croissant.
·Chaque ligne du tableau est appelée : période".
Une
nouvelle période est utilisée à chaque fois
que le remplissage électronique fait intervenir une nouvelle couche.
·Les éléments dont les atomes ont le même nombre
d'électrons sur leur couche externe sont
disposés dans une même colonne ; ils
possède des propriétés chimiques
voisines et constituent "une famille".
|
IONS |
Au cours
de réactions chimiques, les atomes essaient :
-soit de perdre le (ou les) électron(s) isolé(s) de leur couche externe.
- soit de compléter
leur couche externe ( à 8 électrons)
Pour cela
, ils peuvent perdre ou gagner des électrons et se transformer en
"ions" .
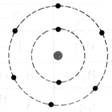
Exemple:
|
Soit
l'atome de sodium . |
Soit
l'atome de chlore
|
|
Lorsque
l'atome de sodium perd un électron, il change de nature. -il
devient électriquement positif -il est
appelé "ion sodium" - son
symbole est Na+
|
Lorsque
l'atome de chlore gagne un électron, il change de nature: -
il devient électriquement
négatif -
c'est l'ion chlorure. -
Son symbole est "cl- "
|
|
Les ions
positifs sont appelés : cations |
Les ions
négatifs sont appelés "anions" |
|
i9 |
Notation
des ions. |
:i |
On précise
la charge de l'ion en indiquant en haut à droite le nombre de charge
élémentaires "e" qu'il porte.
Exemple :
L'atome de
magnésium, au cours de certaines réactions chimiques , perd deux électrons et
donne naissance à un cation portant une charge égale à +2 e.
Cet ion
sera noté : Mg2+
|
|
L ‘atome
de magnésium va perdre 2 électrons , et devient un « cation » |
Autres
exemples :
Cations :
-
ion argent Ag+ (1 charge positive)
-
ion potassium K+ (1 charge positive)
-
ion cuivre (II) Cu2+ (2 charges positives)
-
ion aluminium Al+3 (3 charges positives)
Anions:
-
ion oxyde O2- (1 charge négative)
-
ion fluore F-
(1 charge négative)
-
ion iodure I- (1 charge négative)
|
i9 |
Molécules
|
· Les atomes restent rarement isolés : ils sont en
général associés les uns aux autres pour former des molécules.
Grâce à
ces associations, les atomes acquièrent une structure électronique plus stable
( en saturant leur couche électronique externe).
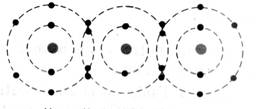
Exemple1 :
|
Deux
atomes d'hydrogène mettent en commun leur électron pour former une molécule
de dihydrogène.( H2 ) |
Molécule
de dihydrogène : les deux atomes
vont « s’ assembler »
les deux
atomes se sont assembler :
|
Exemple 2
|
Deux atomes d'oxygène mettent en commun deux
électrons pour former une molécule de dioxygène (O2) Atome d'oxygène:
|
Molécule
de dioxygène.
|
Exemple 3:
|
Un atome
de chlore et un atome d'hydrogène mettent en commun un électron pour former
une molécule de chlorure d'hydrogène (HCl). Atome
d'hydrogène: |
Atome de
chlore: |
Molécule
de chlorure d'hydrogène. |
Exemple 4:
|
Deux
atomes d'hydrogène et un atome d'oxygène mettent en commun des électrons pour
former une molécule d'eau ( H2O): Atome
d'hydrogène |
Atome
d'oxygène
|
Molécule
d'eau.
|
· A chaque type de molécule, on attribue un nom et une
formule qui traduit sa composition.
Règle :
Pour
écrire la formule d'une molécule, on écrit côte à côte les symboles des éléments
présents dans la molécule en précisant, en indice, en bas à droite, le nombre
d'atomes de chaque élément. L'indice "1" n'est jamais spécifié.
Exemples:
|
Nom de la molécule |
Ecriture symbolique. |
|
Molécule de dioxygène. |
O2 |
|
Molécule de trioxygène |
O3 |
|
Molécule d'eau |
H2O |
|
Molécule de dioxygène de carbone. |
C1O2 = CO2 |
|
Molécule de dichlore. |
Cl2 |
|
Molécule de chlorure d'hydrogène |
H1Cl1 = HCl |
|
Molécule d'ammoniac |
N1H3 = NH3 |
|
Molécule de sucre (saccharose) |
C12 H22 O11 |
· Liaison covalente.
La liaison
covalente consiste en la mise en commun par deux atomes d'une ou de plusieurs
paires d'électrons, appelées "doublets de liaison".
La liaison
covalente est dite
"simple" , "double"
ou "triple" selon que les deux atomes ont mis en commun un , deux ou
trois doublets d'électrons.
En
associant un tiret à chaque liaison covalente, les molécules peuvent de
représenter par des formules développées.
Exemples.
|
Molécule |
Liaison
covalente. |
|
Molécule
d'eau ( H2O) |
H - O -
H |
|
|
|
|
|
|
|
|
|
|
|
|
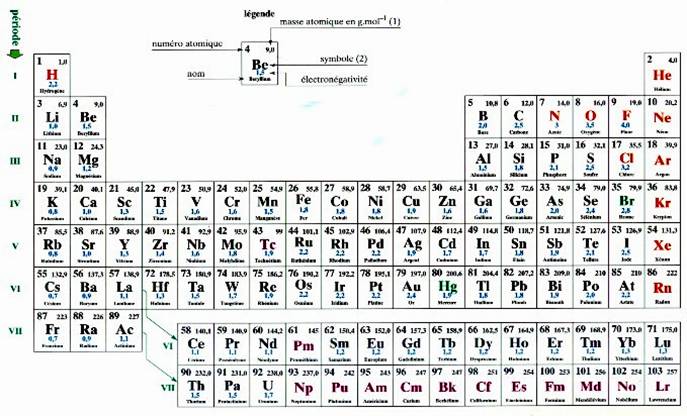
La
classification des atomes ( ou
éléments) suivant leur numéro atomique
« Z » croissant .
Chaque
ligne correspond à un remplissage d’une nouvelle couche ( il y
a 7 couches à remplir)
Nota Chaque couche correspond à différents niveaux
d’énergie des électrons :
Les
électrons qui gravitent autour du noyau se répartissent en couche ( ou
niveaux d’énergie)
Les
couches sont désignées par les lettres : K ; L ; M ;
N ; O ; P ; Q
Chaque
couche peut contenir un nombre maximal d’électrons regroupé dans le tableau
suivant :
|
Nom de la couche |
Nombre maximal d’électrons regroupés dans le tableau |
|
K |
2 |
|
L |
8 |
|
M |
8 |
|
N |
18 |
|
O |
18 |
|
P |
32 |
|
Q |
18 |
ies
électrons remplissent d’abord la couche K , puis la M , ect. ….. pour former la
structure électronique de l’atome
Modèle de
tableau :
Voir la représentation
de LEWIS
|
Leçon |
Titre |
|
N° |
TRAVAUX d ’ AUTO -
FORMATION sur ATOMES - |


 .
.